FAQ
Parmi les catégories de femmes participant peu ou pas au dépistage du cancer du col utérin, se distinguent particulièrement les femmes de plus de 50 ans, et plus la classe d’âge augmente plus cette proportion augmente (44 % chez les 50-54 ans, 50% chez les 55-59 ans, 53% chez les 60-65 ans) (Barré et al. 2017; Hamers et al. 2018).
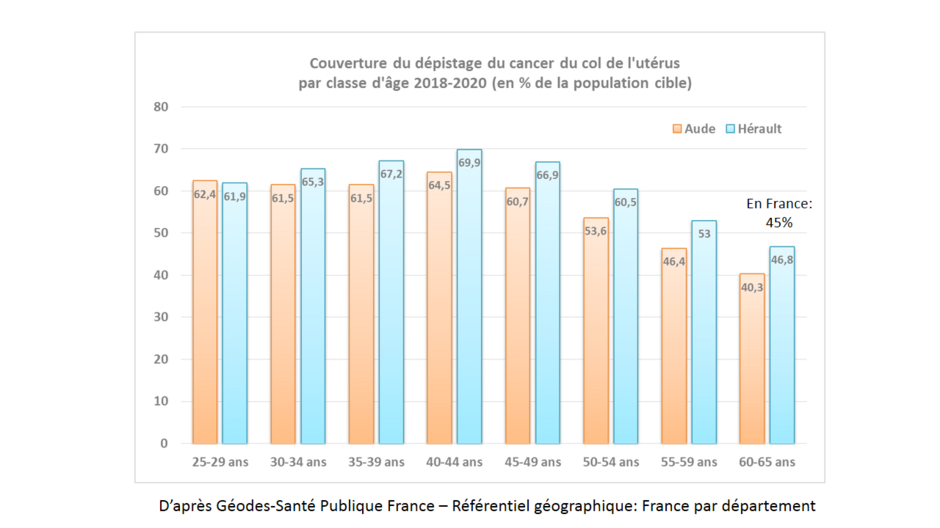
Les dernières données de Santé Public France sur la participation au dépistage du cancer du col sur la période 2018-2020 illustrent tout particulièrement cette baisse de la participation des femmes à partir de l'âge 50 ans dans les Départements de l'Aude et de l'Hérault.
Le dispositif d’auto-prélèvement est un élément clé de Défi’Pap puisqu’il permet de faciliter la démarche de dépistage pour les femmes qui en bénéficient (meilleure adhésion). Il se réalise facilement et rapidement chez soi, au moment que la personne juge le plus opportun, sans avoir à ou attendre ou à prendre un rendez-vous chez un médecin ou un gynécologue ou une sage-femme.
Les auto-prélèvements vaginaux ou urinaires avec test de détection des HPV à haut risque ont fait l’objet de nombreuses publications internationales. L’auto-prélèvement vaginal avec test HR-HPV, utilisé dans l'étude DefiPAP, a notamment été validé dans de nombreuses études par comparaison au prélèvement cervico-utérin réalisé par un professionnel de santé en termes de sensibilité/spécificité pour le dépistage des lésions précancéreuses et cancéreuses du col utérin (Arbyn M et al. 2018).
Depuis 2019, la HAS recommande l’auto-prélèvement vaginal comme alternative au prélèvement cervical par un professionnel de santé, permettant de faciliter le dépistage des femmes qui ne se font jamais dépister ou qui ne se font pas dépister selon le rythme recommandé. Les modalités de recours sont encadrées par un référentiel national de l'INCa depuis Mai 2022.
Différents facteurs peuvent influencer la sensibilité et la spécificité de l'auto-prélèvement vaginal ou urinaire comparativement au prélèvement cervico-vaginal réalisé par un professionnel de santé. Parmi ceux-ci, on trouve le type de dispositif utilisé (écouvillon, brosse, lavage vaginal) et le milieu de recueil du prélèvement (dispositif "sec" ou dispositif dans différents liquides). La technique de détection des HPV à haut risque joue également un rôle important (meilleure sensibilité pour les tests utilisant une technique d'amplification de l'ADN ou PCR).
Les dispositifs d’auto-prélèvements utilisés pour faire le test HPV ne permettent pas pour la plupart d’entre eux de réaliser une analyse cytologique réflexe sur le même prélèvement : ainsi si le test d’auto-prélèvement HPV est positif, la femme doit réaliser un frottis cervico-vaginal chez un professionnel de santé pour son suivi.
Parmi les 200 types d’HPV, les HPV à haut risque (15 types identifiés) sont ceux associés au risque de lésions pré-cancéreuses et cancéreuses du col de l’utérus.
De nombreuses études internationales ont confirmé l’intérêt du test de détection des HPV à haut risque (HR-HPV) pour le dépistage des lésions pré-cancéreuses et cancéreuses du col utérin. En effet, ce test est plus sensible, bien que légèrement moins spécifique, que l’analyse cytologique des frottis pour détecter les lésions de haut grade du col utérin (CIN2+) (Ronco et al. 2014; Mustafa et al. 2016).
En juillet 2019, la Haute Autorité de Santé a renouvelé ses recommandations pour le dépistage primaire du cancer du col utérin et recommandé d’utiliser le test de détection des HPV à haut risque (HR-HPV) pour toutes les femmes de plus de 30 ans, avec un intervalle entre 2 tests de 5 ans en cas de test HR-HPV négatif. Le test HR-HPV est remboursé dans cette indication depuis avril 2020 est pris entièrement en charge dans cadre du dépistage organisé depuis Juillet 2020 (Journal Officiel Arrêté du 30 juillet 2020).
Le projet Defi'PAP cible 2 départements de la Région Occitanie: l'Aude et l'Hérault. Sur la période 2018-2020, l'Aude est le département de la région Occitanie avec le plus faible taux de participation au dépistage du cancer du col (55,9%). La participation des femmes de l'Hérault à ce dépistage est légèrement supérieure à la moyenne nationale (61,1%) mais reste insuffisante. Dans ces deux Départements, la participation au dépistage chute à partir de l'âge de 50 ans chez les femmes âgées de 60 à 65 ans pour atteindre moins de 47%.
Le mammobile : dans l’Hérault, l’association AMHDCS (Association Montpellier-Hérault du Dépistage du Cancer du Sein) propose aux femmes de réaliser leur dépistage du cancer du sein dans une unité mobile : le mammobile. Ce mammobile est mobilisé presque tous les jours ouvrables dans l’Hérault, couvant environ 250 communes du Département. Il sillonne des zones rurales à faible densité médicale et des zones urbaines dans les quartiers prioritaires de la ville, ciblant des femmes de plus de 50 ans dont l’accès au soin est difficile et/ou qui sont issues des quartiers défavorisés.
C’est à partir des passages des unités mobiles dans des zones présentant les plus faibles taux de participation au dépistage que seront recrutées les femmes de l’Hérault.
La Maison des Solidarités de la Haute Vallée : au sein de l’Aude, le territoire des deux regroupements de communes du Limouxin et des Pyrénées Audoises, auquel la Maison Départementale des Solidarités (MDS) de la Haute Vallée de Limoux-Quillan est rattachée, présente des niveaux d’indicateurs socio-économiques globalement similaires ou légèrement inférieurs à ceux du département audois (CREAI-ORS Occitanie 2019).
C’est à partir de cette MDS de la Haute Vallée que seront recrutées les femmes dans l’Aude.
Institut National du Cancer :
- Information régulièrement mise à jour : https://www.e-cancer.fr/Professionnels-de-sante/Depistage-et-detection-precoce/Depistage-du-cancer-du-col-de-l-uterus
- 2022, référentiel national : https://www.e-cancer.fr/Expertises-et-publications/Catalogue-des-publications/Referentiel-national-Depistage-du-cancer-du-col-de-l-uterus-cadre-et-modalites-de-recours-aux-autoprelevements-vaginaux
Santé Publique France :
- 2020, indicateurs de performance du dépistage du CCU : https://www.santepubliquefrance.fr/maladies-et-traumatismes/cancers/cancer-du-col-de-l-uterus/documents/guide/depistage-organise-du-cancer-du-col-de-l-uterus.-definition-des-indicateurs-de-performance-et-format-des-donnees-pour-l-evaluation-du-programme-nat
- Chiffres d’incidence et mortalité, dépistage et vaccination, mise à jour en janvier 2022 : https://www.santepubliquefrance.fr/maladies-et-traumatismes/cancers/cancer-du-col-de-l-uterus/articles/depistage-du-cancer-du-col-de-l-uterus
- Mise à jour des données de couverture du dépistage pour la période 2018-2020, disponible sur Géodes (https://geodes.santepubliquefrance.fr/#c=home)
Les données sont accessibles par ici :
- https://geodes.santepubliquefrance.fr/#c=home
- Choisir indicateurs « par déterminant » puis cliquer sur D > Dépistage > Dépistage de cancers :
- Dépistage du cancer de l’utérus par période triennale
- Dépistage du cancer de l’utérus par classe d’âge
- Ne pas oublier de sélectionner la région Occitanie ou un de ses départements sur la carte (le choix du niveau géographique se fait dans le bandeau à gauche : choix du découpage géographique)
Haute Autorité de Santé :
- 2019 : recommandations : https://www.has-sante.fr/jcms/c_2806160/fr/evaluation-de-la-recherche-des-papillomavirus-humains-hpv-en-depistage-primaire-des-lesions-precancereuses-et-cancereuses-du-col-de-l-uterus-et-de-la-place-du-double-immuno-marquage-p16/ki67
- 2013 : recommandations: https://www.has-sante.fr/jcms/c_1623735/fr/depistage-et-prevention-du-cancer-du-col-de-l-uterus
Légifrance : Arrêté du 30 juillet 2020 modifiant l'arrêté du 29 septembre 2006 relatif aux programmes de dépistage organisé des cancers et relatif à l'organisation du dépistage organisé du cancer du col de l'utérus
Arbyn M, Smith SB, Temin S, Sultana F, Castle P and Collaboration on Self-Sampling and HPV Testing. 2018. Detecting cervical precancer and reaching underscreened women by using HPV testing on self samples: updated meta-analyses. British Medical Journal 363(Dec 5): k4823.
Arbyn, M., C. Depuydt, I. Benoy, J. Bogers, K. Cuschieri, M. Schmitt, M. Pawlita, D. Geraets, I. Heard, T. Gheit, M. Tommasino, M. Poljak, J. Bonde and W. Quint. 2015. VALGENT: A protocol for clinical validation of human papillomavirus assays. J Clin Virol 76(Suppl 1): S14-S21.
Arbyn, M., F. Verdoodt, P. Snijders, V. Verhoef, E. Suonio, L. Dillner, S. Minozzi, C. Bellisario, R. Banzi, F. Zhao, P. Hillemanns and A. Anttila. 2014. Accuracy of human papillomavirus testing on self-collected versus clinician-collected samples: a meta-analysis. Lancet Oncol 15(2): 172-83.
Barré, S., M. Massetti, H. Leleu, N. Catajar and F. de Bels. 2017. Caractérisation des femmes ne réalisant pas de dépistage du cancer du col de l'utérus par frottis cervico-utérin en France. Bull Epidémiol Hebd 2-3: 39-47.
Bertucci, M., E. Bonnet, L. Stager, A. Khreiche, J.C. Chappert, S. Loy-Morel, S. Segondy, J.P. Daures, and N. Boulle. 2020. Acceptability of vaginal self-sampling with high-risk human papillomavirus testing for cervical cancer screening : a French questionnaire-based study. Women & Health 61(1) : 83-94.
Bergengren, L., M. Kaliff, G. Larsson, M. Karlsson and G. Helenius. 2018. Comparison between professional sampling and self-sampling for HPV-based cervical cancer screening among postmenopausal women. Int J Gynaecol Obstet 142(3): 359-364.
Broc, G. and A. Edjolo. 2017. Communiquer plus efficacement en prévention. Modèle intégratif et recommandations à l'usage des professionnels de la santé publique. Revue d'Epidémiologie et de Santé Publique 65: 149-158.
Chorley, A. J., L. A. V. Marlow, A. S. Forster, J. B. Haddrell and J. Waller. 2017. Experiences of cervical screening and barriers to participation in the context of an organised programme: a systematic review and thematic synthesis. Psychooncology. 26(2): 161-72. Epub 2016 Apr 12 doi:10.1002/pon.4126.
Dalstein, V., B. Charlier, J. Botokeky, E. Mereb, D. Fabre, O. Graesslin and C. Clavel. 2014. Interim evaluation of START-HPV, pilot programme of HPV-based primary screening for cervical precancerous and cancerous lesions in the Ardennes area, France, 2012-2013. Bull Epidémiol Hebd 13-14-15: 254-9.
Ejegod, D. M., H. Pedersen, G. P. Alzua, C. Pedersen and J. Bonde. 2018. Time and temperature dependent analytical stability of dry-collected Evalyn HPV self-sampling brush for cervical cancer screening. Papillomavirus Res. 5:192-200.(doi): 10.1016/j.pvr.2018.04.005. Epub 2018 Apr 22.
Gupta S, Palmer S, Bik EM, Cardenas JP, Nuñez H, Kraal L, Bird SW, Bowers J, Smith A, Walton NA, Goddard AD, Almonacid DE, Zneimer S, Richman J and Apte Z. 2018. Self-Sampling for Human Papillomavirus Testing: Increased Cervical Cancer Screening Participation and Incorporation in International Screening Programs. Front Public Health 6(Apr 9): 77.
Haguenoer, K., S. Sengchanh, C. Gaudy-Graffin, J. Boyard, R. Fontenay, H. Marret, A. Goudeau, N. Pigneaux de Laroche, E. Rusch, B. Giraudeau and N. d. b. E. S. 23. 2014. Vaginal self-sampling is a cost-effective way to increase participation in a cervical cancer screening programme: a randomised trial. Br J Cancer 111(11): 2187-96.
Hamers, F. F., N. Duport and N. Beltzer. 2018. Population-based organized cervical cancer screening pilot program in France. Eur J Cancer Prev 27(5): 486-492.
Haute Autorité de Santé. 2019. Evaluation de la recherche des papillomavirus humains (HPV) en dépistage primaire des lésions précancéreuses et cancéreuses du col de l'utérus et de la place du double immuno-marquage p16/Ki67- Synthèse et Recommandations. Recommandations en santé publique, HAS.
Hope, K. A., E. Moss, C. W. E. Redman and S. M. Sherman. 2017. Psycho-social influences upon older women's decision to attend cervical screening: A review of current evidence. Prev Med. 101:60-66.(doi): 10.1016/j.ypmed.2017.05.002. Epub 2017 May 11.
Institut National de la Statistique et des Etudes économiques. 2018. Les départements d’Occitanie au regard des autres départements de province. Insee. N°8. Octobre 2018. https://www.insee.fr/fr/statistiques/3629121?sommaire=3629137. 2020.
Journal Officiel. Arrêté du 4 mai 2018 Relatif à l'organisation du dépistage organisé du cancer du col de l'utérus. Legifrance.
Journal Officiel. Arrêté du 30 juillet 2020. Arrêté relatif aux programmes de dépistage organisé dus cancers et relatif à l'organisation du dépistage organisé du cancer du col de l'utérus. Légifrance.
Ketelaars, P. J. W., R. P. Bosgraaf, A. G. Siebers, L. Massuger, J. C. van der Linden, C. A. P. Wauters, J. C. Rahamat-Langendoen, A. J. C. van den Brule, J. IntHout, W. J. G. Melchers and R. L. M. Bekkers. 2017. High-risk human papillomavirus detection in self-sampling compared to physician-taken smear in a responder population of the Dutch cervical screening: Results of the VERA study. Prev Med. 101:96-101.
Leinonen, M., K. Schee, C. Jonassen, A. Lie, C. Nystrand, A. Rangberg, I. Furre, M. Johansson, A. Tropé, K. Sjøborg, P. Castle and M. Nygård. 2018. Safety and acceptability of human papillomavirus testing of self-collected specimens: A methodologic study of the impact of collection devices and HPV assays on sensitivity for cervical cancer and high-grade lesions. J Clin Virol 99-100: 22-30.
Limmer, K., G. LoBiondo-Wood and J. Dains. 2014. Predictors of cervical cancer screening adherence in the United States: a systematic review. J Adv Pract Oncol. 5(1): 31-41.
Rijkaart, D., J. Berkhof, F. van Kemenade, V. Coupe, L. Rozendaal, D. Heideman, R. Verheijen, S. Bulk, W. Verweij, P. Snijders and C. Meijer. 2012. HPV DNA testing in population-based cervical screening (VUSA-Screen study): results and implications. Br. J. Cancer 106(5): 975-81.
Rohleder, P. and A. Lyons (2014). Qualitative research in clinical and health psychology. P. Rohleder, & Lyons, A. Basingstoke: Palgrave Macmillan.
Ronco, G., J. Dillner, K. Elfström, S. Tunesi, P. Snijders, M. Arbyn, H. Kitchener, N. Segnan, C. Gilham, P. Giorgi-Rossi, J. Berkhof, J. Peto, C. Meijer and I. H. s. w. group. 2014. Efficacy of HPV-based screening for prevention of invasive cervical cancer: follow-up of four European randomised controlled trials. Lancet 383(9916): 524-32.
Tamalet, C., P. Halfon, L. Retraite, A. Grob, F. Leandri, P. Heid, H. Sancho-Garnier and L. Piana. 2016. Genotyping and follow-up of HR-HPV types detected by self-sampling in women from low socioeconomic groups not participating in regular cervical cancer screening in France. J Clin Virol 78: 102-7.
Tranberg, M., B. H. Bech, J. Blaakaer, J. S. Jensen, H. Svanholm and B. Andersen. 2018. HPV self-sampling in cervical cancer screening: the effect of different invitation strategies in various socioeconomic groups - a randomized controlled trial. Clin Epidemiol. 10:1027-1036.(doi): 10.2147/CLEP.S164826. eCollection 2018.
Yeh PT, Kennedy CE, de Vuyst H and Narasimhan M. 2019. Self-sampling for human papillomavirus (HPV) testing: a systematic review and meta-analysis. BMJ Glob Health 4(3): e001351.